En savoir davantage sur la synthèse hydrothermale en continu
Les perspectives d'une utilisation à l'échelle industrielle de nanopoudres s'élargissent de jour en jour, notamment celles des oxydes nanostructurés (ZnO, TiO2, ZrO2, SnO2, Fe2O3) utilisés dans les domaines de la nanotechnologie. Les voies de production de ces nanomatériaux sont variées mais il sera impératif dans un bref avenir de disposer de matériaux d'excellente qualité (absence de défauts cristallins, d'espèces adsorbées incontournables autres que H2O ou OH-) tout en privilégiant des voies de synthèse propres et respectueuses de l'environnement. Parmi toutes les voies de synthèses possibles, la synthèse de nanopoudres en milieu solvothermal présente de nombreux avantages et répond en particulier aux contraintes précédemment citées. En effet, le processus de thermohydrolyse qui intervient ne nécessite généralement pas de réactif secondaire, d'un milieu réactionnel « propre » : ce qui limite considérablement les rejets polluants.
La synthèse en eau supercritique existe depuis longtemps en réacteurs « batch ». Cependant, le principal inconvénient d'un tel dispositif fermé est l'inertie thermique du réacteur qui doit résister à l'effet conjugué de la température et de la pression, et des variations de températures qui en résultent dans le milieu réactionnel. Ces limitations peuvent être supprimées dans un dispositif en continu.
Dans ce contexte, l'équipe MaNaPI du département Nanosciences de l'ICB a développé (depuis 2001) un dispositif de production en continu de nanoparticules d'oxydes et d'hydroxydes (Figure 1) synthétisés en milieu eau sous et supercritique [1-2].

Figure 1 : Dispositif de synthèse en continu de nanoparticules d'oxydes et d'hydroxydes en milieu eau sous et supercritique développé au Laboratoire ICB au sein de l'équipe MaNaPI (version 1 semestre 2008)
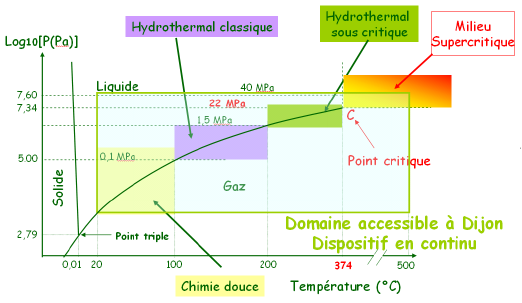
Figure 2 : Diagramme d'état de l'eau illustrant les domaines de synthèses accessibles grâce au dispositif développé au sein de l'équipe MaNaPI (Figure 1)
Cet appareillage permet de synthétiser des nanopoudres par chimie douce, en milieu hydrothermal classique, hydrothermal sous critique et milieu supercritique (Figure 2). Le dispositif actuel permet une production moyenne de 10 à 15 g/heure de poudre sèche. Les particules de tailles nanométriques sont généralement très bien cristallisées et ne nécessitent aucun traitement thermique supplémentaire après récupération : un avantage considérable de ce type de préparation par rapport aux synthèses par chimie douce.
Depuis sa conception, le dispositif est sans cesse en phase d'optimisation afin (1) d'augmenter la capacité de production à 100 g/heure et (2) de réduire le coût de production afin d'être compétitif faces aux fournisseurs de nanopoudres. La finalité est de concevoir une installation à l'échelle semi-industrielle à plus ou moins long terme.
D'un point de vue fondamental, la compréhension des mécanismes de germination/croissance en milieux solvothermal sous et supercritiques a également une part importante dans ce travail. Par voie de conséquence, une meilleure maîtrise des conditions de synthèse permettra de contrôler les étapes déterminantes et ainsi de produire des nanopoudres bien maîtrisées (taille, morphologie, compositions chimiques de cœur et de surface, …).
Cependant, les conditions d'obtention du milieu eau supercritique étant drastiques (haute température : 374°C et haute pression : 22,1 MPa), il est très difficile de pouvoir suivre les réactions de synthèse de manière in-situ par des mesures de pH et prises de prélèvement. C'est pour cette raison que la modélisation est de plus en plus employée afin de mieux comprendre les mécanismes réactionnels entrant en jeu. Dans cette étude, il est envisagé de modéliser les mécanismes réactionnels à l'aide du logiciel FLUENT 6.3. Les prédictions apportées par cet outil permettent d'avoir accès à des informations qui ne seraient pas accessibles expérimentalement telles que les vitesses de germination et croissance des particules ou bien encore les sites privilégiés de réaction.
La première partie de ce projet est consacrée à la synthèse de l'oxyde de zinc ZnO puisque ce semi-conducteur est de plus en plus impliqué dans le monde des Nanotechnologies notamment dans les domaines des composants opto-électroniques (cellule photovoltaïque, diode électroluminescente), produits cosmétiques (filtre UV) et procédés de production d'hydrogène (cycle Zn/ZnO).
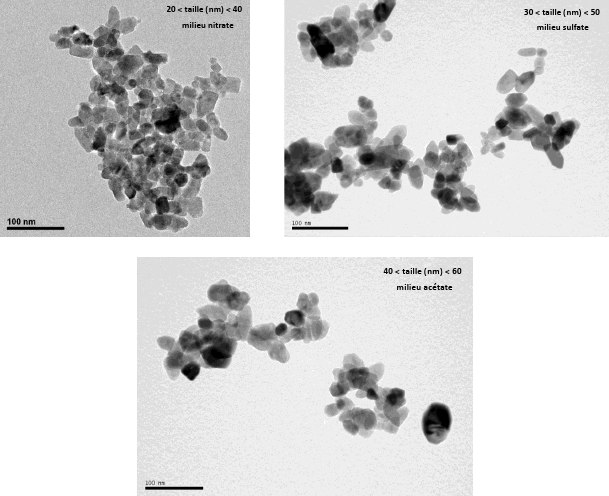
Les différentes recherches bibliographiques sur la synthèse de ZnO en milieu eau-supercritique [3-10] ont permis de tester la faisabilité de cette synthèse via le dispositif. A partir des travaux d'Ohara et al. (2004) [3], la mise au point d'un protocole de synthèse à partir d'une solution de nitrate de zinc en milieu neutre ou basique (par ajout de soude) permet de préparer des nanopoudres parfaitement bien cristallisées comme l'attestent les différentes caractérisations du matériau (Figure 3). La diffraction des rayons X ainsi que la spectroscopie Raman révèlent la présence d'une phase cristalline ZnO et les microscopies électroniques MEB et MET mettent en évidence une poudre de granulométrie inférieure à 100 nm, majoritairement des nanoparticules de diamètre compris entre 15 et 20 nm. De plus, le rapport [Zn(II)]/[OH], la nature du sel métallique (nitrate, acétate ou sulfate de zinc), la température du réacteur, le temps de séjour (fonction des débits des réactifs) semblent influencer directement la taille et la morphologie des nanoparticules comme indiqué dans les travaux de Sue et al. (2004) [9]. Par exemple, les images obtenues par MET (Figure 4) indiquent la présence de nanoparticules sphériques de quelques dizaines de nanomètres lorsque la synthèse est réalisée en milieu basique (ajout de soude). En absence de soude, les particules sont plus grosses et des morphologies différentes apparaissent : présence d'aiguilles d'une centaine de nanomètres. La nature du sel métallique semble également agir sur la morphologie des nanopoudres (Figure 5) : la nature du contre ion (nitrate, sulfate et acétate) joue un rôle sur la taille et la morphologie des produits synthétisés.
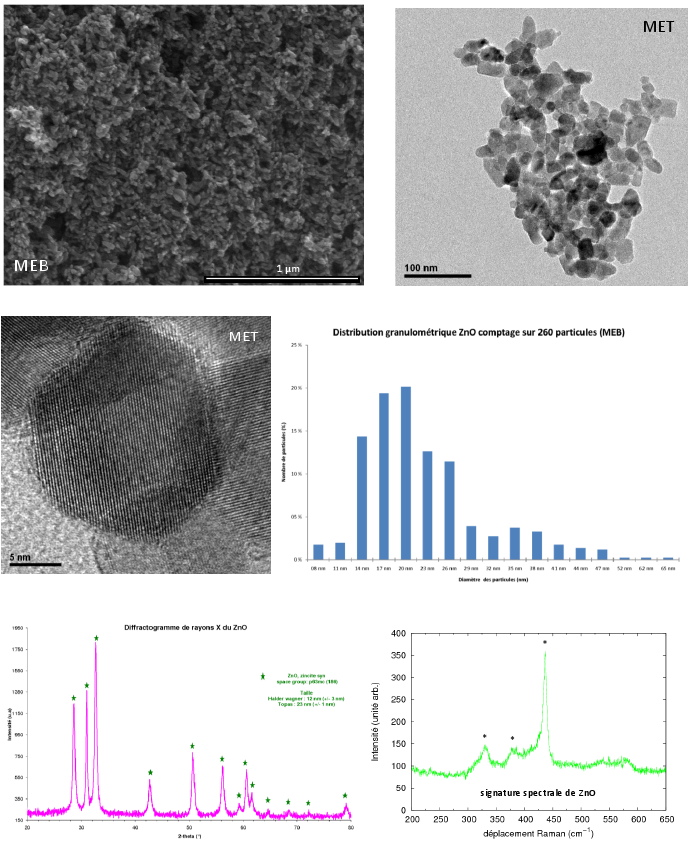
Figure 3 : Caractérisations d'une poudre de ZnO obtenue par le dispositif hydrothermal en continu développé au sein de l'équipe MaNaPI : Imageries (MET et MEB), distribution granulométrique, DRX, spectroscopie Raman
D'autres nanomatériaux ont également été synthétisés tels que ZrO2, TiO2. Concernant l'oxyde de zirconium (ZrO2), la mise au point d'un protocole de synthèse à partir d'une solution d'oxo nitrate de zirconium en milieu neutre ou basique (par ajout de soude), inspirée des travaux de [11-13], permet d'obtenir des nanopoudres parfaitement bien cristallisées comme l'atteste l'analyse morphologique du matériau par MET (Figure 6) : obtention d'une poudre de granulométrie inférieure à 10 nm, majoritairement des nanoparticules de diamètre compris entre 6 et 8 nm. La caractérisation par DRX (Figure 6) indique un mélange de deux phases : phase monoclinique et phase tétragonale. La poursuite de l'étude va consister à optimiser le procédé de synthèse afin de contrôler la taille et le type de phase du matériau.
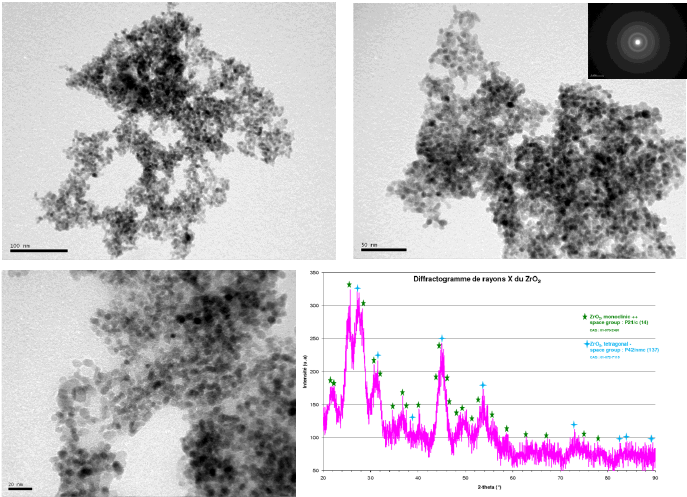
Figure 6 : Caractérisations d'une poudre de ZrO2 obtenue via le dispositif hydrothermal en continu: Imagerie (MET) et DRX. Conditions de synthèse : [Zr(NO3)2] = 0,05 mol/l, débit total : 30 ml/min, P = 300 bar, T fluide : 500°C, rdt. : 48%)
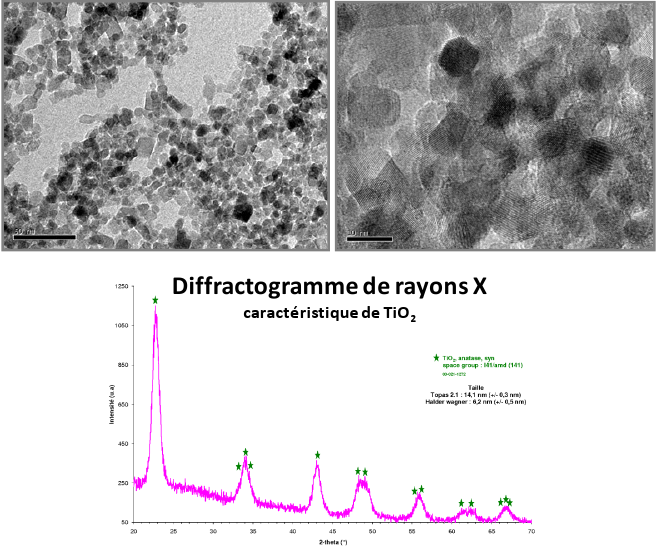
Quant à l'oxyde de titane (TiO2), il a été préparé à partir d'une solution de bis(ammoniolactato) dihydroxotitane (IV) (ALT) de formule [CH3CH(O)CO2NH4]2Ti(OH)2 à partir des travaux de Catherine Pighini [14-15]. Ce protocole permet d'obtenir des nanopoudres également parfaitement bien cristallisées comme l'atteste l'analyse morphologique du matériau par MET (Figure 7) : obtention d'une poudre de granulométrie inférieure à 10 nm, majoritairement des nanoparticules de diamètre compris entre 6 et 10 nm. La caractérisation par DRX (Figure 6) indique une phase de type anatase. La poursuite de l'étude va également consister à optimiser le procédé de synthèse afin de contrôler la taille et le type de phase du matériau.
Actuellement, une mise au point d'un protocole de synthèse d'alumine (γ-Al2O3) à partir des travaux de Takio Noguchi et al. (2008) est à l'essai [16]. La difficulté réside dans la variété des phases oxydes et hydroxydes de l'aluminium existantes fonction notamment de la température :
γ-AlOOH → γ-Al2O3 → δ-Al2O3 → θ-Al2O3 → α-Al2O3
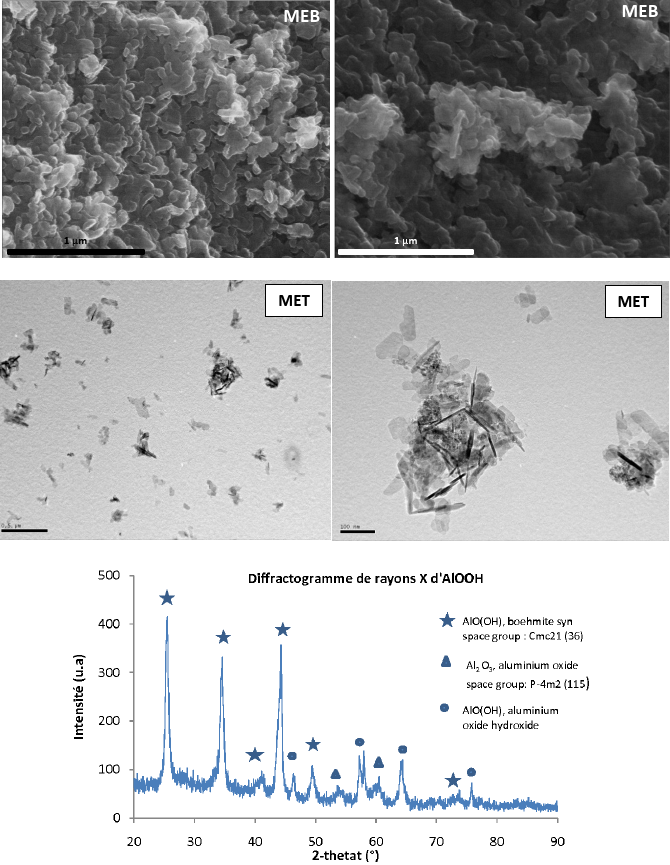
Une série d'expériences a été réalisée à partir de nitrate d'aluminium(III) en milieu eau-supercritique. Les premiers résultats indiquent la formation de la bohemite (γ-AlOOH) comme l'atteste la caractérisation par DRX (Figure 8) avec vraisemblablement une faible quantité d'alumine. L'analyse morphologique du matériau par MEB et MET (Figure 8) révèle une phase cristallisée présentant différentes morphologies (aiguilles 3 x 80 nm, plaquettes 100 x 35 nm et amas de particules 6 nm de diamètre (valeurs moyennes)). Une amélioration du dispositif au niveau du système de préchauffage de l'eau devra être réalisée afin d'obtenir la phase γ-Al2O3. Actuellement, la température de l'eau semble insuffisante pour obtenir directement la phase attendue.
[1] Aimable, A.; Muhr, H.; Gentric, C.; Bernard, F.; Le Cras, F.; Aymes, D. Continuous hydrothermal synthesis of inorganic nanopowders in supercritical water: Towards a better control of the process. Powder Technology (2009), 190(1-2), 99-106.
[2] Aimable, A.; Xin, B.; Millot, N.; Aymes, D. Continuous hydrothermal synthesis of nanometric BaZrO3 in supercritical water. Journal of Solid State Chemistry (2008), 181(1), 183-189.
[3] Ohara, Satoshi; Mousavand, Tahereh; Umetsu, Mitsuo; Takami, Seiichi; Adschiri, Tadafumi; Kuroki, Yuichiro; Takata, Masasuke. Hydrothermal synthesis of fine zinc oxide particles under supercritical conditions. Solid State Ionics (2004), 172(1-4), 261-264.
[4] Ohara, Satoshi; Mousavand, Tahereh; Sasaki, Takafumi; Umetsu, Mitsuo; Naka, Takashi; Adschiri, Tadafumi. Continuous production of fine zinc oxide nanorods by hydrothermal synthesis in supercritical water. Journal of Materials Science (2008), 43(7), 2393-2396.
[5] Vostrikov, A. A.; Shishkin, A. V.; Timoshenko, N. I. Synthesis of ZnO nanostructures and H2 by reactions of Zn with H2O. Russian Chemical Bulletin (2006), 55(12), 2291-2293.
[6] Vostrikov, A. A.; Shishkin, A. V.; Timoshenko, N. I. Synthesis of zinc oxide nanostructures during zinc oxidation by sub and supercritical water. Technical Physics Letters (2007), 33(1), 30-34 [7] Viswanathan, Raghu; Gupta, Ram B. Formation of zinc oxide nanoparticles in supercritical water. Journal of Supercritical Fluids (2003), 27(2), 187-193.
[8] Sue, Kiwamu; Kimura, Kazuhito; Arai, Kunio. Hydrothermal synthesis of ZnO nanocrystals using microreactor. Materials Letters (2004), 58(25), 3229-3231
[9] Sue, Kiwamu; Kimura, Kazuhito; Murata, Kenji; Arai, Kunio. Effect of cations and anions on properties of zinc oxide particles synthesized in supercritical water. Journal of Supercritical Fluids (2004), 30(3), 325-331.
[10] Reverchon, E.; Della Porta, G.; Sannino, D.; Ciambelli, P. Supercritical antisolvent precipitation of nanoparticles of a zinc oxide precursor. Powder Technology (1999), 102(2), 127-134.
[11] Adschiri, Tadafumi; Kanazawa, Katsuhito; Arai, Kunio. Rapid and continuous hydrothermal crystallization of metal oxide particles in supercritical water. Journal of the American Ceramic Society (1992), 75(4), 1019-22.
[12] Kim, Jeong-Rang; Myeong, Wan-Jae; Ihm, Son-Ki. Characteristics in oxygen storage capacity of ceria zirconia mixed oxides prepared by continuous hydrothermal synthesis in supercritical water. Applied Catalysis, B: Environmental (2007), 71(1-2), 57-63.
[13] Catherine Pighini, Synthèses de nanocristaux de TiO2 anatase à distribution de taille contrôlée. Influence de la taille des cristallites sur le spectre Raman et étude des propriétés de surface. Thèse de Doctorat de l'Université de Bourgogne Mention Sciences, Spécialité Chimie-Physique présentée par le 30 novembre 2006
[14] Baowei Xin, De la chimie douce, au milieu hydrothermal étendu au domaine supercritique, du réacteur fermé au dispositif en continu : synthèse d'oxydes métalliques nanostructurés. Thèse de Doctorat de l'Université de Bourgogne Mention Sciences, Spécialité Chimie-Physique présentée par le 16 juin 2005
[15] Mockel, Hermann; Giersig, Michael; Willig, Frank. Formation of uniform size anatase nanocrystals from bis ( ammonium lactato ) titanium dihydroxide by thermohydrolysis. Journal of Materials Chemistry (1999), 9(12), 3051-3056.
[16] Noguchi, Takio; Matsui, Keitaro; Islam, Nazrul M.; Hakuta, Yukiya; Hayashi, Hiromichi. Rapid synthesis of Al2O3 nanoparticles in supercritical water by continuous hydrothermal flow reaction system. Journal of Supercritical Fluids (2008), 46(2), 129-136
Synthèse hydrothermale
La synthèse continue de nano-particules d'oxyde métallique par voie hydrothermale est effectuée à partir d'un prototype développé et installé dans notre laboratoire. Ce dispositif permet l'élaboration de nano-particules d'oxydes simples ou poly-cationiques (ZnO, TiO2, ZrO2, CeO2, Y2O3, CeZrO2 …) parfaitement cristallisées avec une distribution granulométrique resserrée et pouvant atteindre des tailles inférieures à 10 nm. Ces nano-particules peuvent être utilisées dans des applications biomédicale, en catalyse ou en métallurgie comme dispersoïdes.
Contact : F. Demoisson, I. Gallet, F. Bernard